日本の製造販売システム
日本ではどのように化粧品がつくられて販売されているか
普段なにげなく手にして、購入し、使っている化粧品。そのために動物たちがどのような犠牲を強いられているのか、ご存知でしょうか。ここでは、動物実験がどのような場合に行なわれているかということを含めて、日本における化粧品の製造販売のシステムについてご説明します。
「化粧品」「医薬部外品」「医薬品」
「化粧品」「医薬部外品」は、「医薬品」とともに、厚生労働省が所管する法律「医薬品、医薬機器等の品質、有効性及び安全性の確保等に関する法律(以下「薬機法)」のもとで管理されています。それぞれ定義も規制も異なります。
「化粧品」とは、「人の身体を清潔にし、美化し、魅力を増し、容貌を変え、又は皮膚若しくは毛髪をすこやかに保つために、身体に塗擦、散布その他これらに類似する方法で使用されることが目的とされている物で、人体に対する作用が緩和なもの」(薬機法第2条第3項)と定義されています。ファンデーション、口紅などのメイクアップ化粧品、化粧水や乳液などの基礎化粧品のほか、シャンプーや石けんなどもこれに該当します。
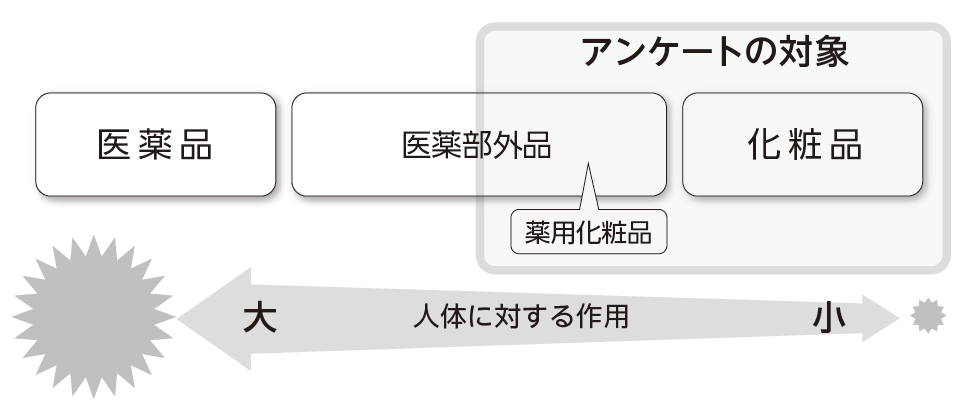
一方、美白化粧品やニキビ用化粧品などの「薬用化粧品」と呼ばれるものは、「薬用」という言葉のとおり、「医薬品」ほどではないけれど、「化粧品」よりも人体に対する作用が認められるものであるため、「化粧品」ではなく「医薬部外品」の範疇に入ります。「薬用石けん」「薬用ハミガキ」、パーマ・カラーリング剤、除毛剤や育毛剤もこれに該当します。
これに対して「医薬品」とは、「人又は動物の身体の構造又は機能に影響を及ぼすことが目的とされている物」(薬機法第2条第1項第3号)等をさします。
一般化粧品には動物実験は義務づけられていない
薬事法が改正される2001年までは、「化粧品種別許可申請制度」によって、「化粧品」の製造販売は、事前に国からの承認を受けることが必要でした。そのなかでも、過去国内で化粧品に使用されたことのない成分を配合する場合に、厚生省(現・厚生労働省)から動物実験による毒性試験のデータ提出が義務づけられていました。これまでは、海外ですでに動物実験による毒性試験が行なわれた上で流通している成分を日本に輸入しようとする場合、改めて動物実験を行なわなければなりませんでした。
これに対し、1990年代後半に「海外ではすでに広く使用されているのに、日本で使用前例がないというだけで、承認許可を求められるのは流通の妨げになる」など産業界から規制緩和を求める声が大きくなり、2001年3月に、化粧品の種別ごとに承認を受ける制度は廃止となりました。これによって、国が企業に対して一般化粧品に動物実験を義務づけているという状況は解消されました。
『化粧品基準』と動物実験
この薬事法改正に伴って、欧米との制度の整合性を図っていくために『化粧品基準』(平成12年9月厚生省告示第331号)が定められ、配合成分を禁止・制限する方式が導入されました。厚生労働省が公表する化粧品基準のリストに示されているものに違反しない限り、企業責任のもとで安全性を確保できれば、いままで使用されたことのない成分でも自由に配合して化粧品をつくることができるようになっています。
ところが、もしメーカーが、たとえば「新たな紫外線吸収剤を開発したので、ポジティブリストに追加してほしい」「医薬品の成分だが、ぜひ化粧品の成分として認めてほしい」というように、すでに厚生労働省で定めているリストに新たに成分を追加したり、リストの成分の最大配合量を変更してもらおうと化粧品基準の改正を要請する場合に、下表の12種類の毒性試験が義務付けられています。そのうち、ヒトパッチ試験を除く11種類の試験に動物実験が含まれます〈*1〉。
〈*1〉「ポジティブリスト収載要領について」 (平成13年3月29日医薬審発第325号)、「化粧品への配合を希望する医薬品の成分の取り扱いについて(依頼)」(平成16年3月25日薬食審査発第0325019号)
化粧品基準改正要請時に求められる毒性試験
- 単回投与毒性に関する資料
- 反復投与毒性に関する資料
- 生殖発生毒性に関する資料
- 皮膚一次刺激性に関する資料
- 連皮膚一次刺激性に関する資料
- 感作性に関する資料
- 光毒性に関する資料 注1
- 光感作性に関する資料 注2
- 眼刺激性に関する資料
- 遺伝毒性に関する資料
- ヒトパッチに関する資料
- 吸収・分布・代謝・排泄に関する資料
注1, 注2 吸光度測定によって紫外部に吸収がない場合には省略できる。
※「ポジティブリスト収載要領について」(平成13年3月29日医薬審発第325号)の「別表」より抜粋
企業責任と動物実験
現在の化粧品規制は、企業責任を大前提としています。「化粧品基準」に違反しない限り、何を配合するかも自由であり、すべてはメーカーの裁量で行なうことができます。その分、消費者の安全確保についても責任を負わなければならず、万が一事故が起きた場合には、商品の回収も義務づけられているなど、企業責任の範囲は以前にも増して大きくなりました。
でも、そうなると動物実験の数が増えるのではないかと心配される方がいらっしゃるかもしれませんが、実際はそういう訳ではないのです。
そもそも動物実験を行なうには、自社で動物実験ができる施設を持つか、あるいは外部の研究機関に委託するなどの費用と時間がかかります。国内で使用実績のない成分を使用する場合でも、過去に行なわれた毒性試験のデータなど安全性を担保できる資料を揃えておけばよく、費用を投じてまで、あえて動物実験をする必要はないのです。
薬用化粧品(医薬部外品)と動物実験
医薬部外品の規制は、化粧品のそれとは異なり、医薬品の規制に準じて行なわれています。そのため、これまでの医薬部外品と異なる有効成分を配合したり、有効成分の適用方法が明らかに異なる薬用化粧品をつくる場合は、下表の11種類の毒性試験が義務付けられています。また、新添加物を配合するなどの場合にも、動物実験が行なわれます。すでに承認されている成分で従来どおりの方法で作れば、新たに動物実験をする必要はありません。
「化粧品」と「医薬品」の2分類しかない欧米では、日本の薬用化粧品は「化粧品」として販売されています〈*2〉。制度や分類が違うだけで、本来なら必要のない動物実験が、日本では行なわれてしまっているという憂うべき現状もあります。
〈*2〉紫外線吸収剤など一部の製品については米国では医薬品として分類されています。
医薬部外品の承認申請時に求められる毒性試験
- 単回投与毒性に関する資料
- 反復投与毒性に関する資料
- 遺伝毒性に関する資料
- がん原性に関する資料
- 生殖発生毒性に関する資料
- 局所刺激性に関する資料
- 皮膚感作性に関する資料
- 光安全性に関する資料
- 吸収・分布・代謝・排泄に関する資料
- ヒトパッチテストに関する資料
- ヒトにおける長期投与(安全性)試験に関する資料
※「医薬部外品等の承認申請について」(平成26年11月21日薬食発1121第7号)の「別表1」より抜粋
全成分表示
薬機法では、化粧品について水やアルコールに始まるすべての配合成分の表示が義務づけられています。ただし、企業秘密であるとして非開示が認められた成分(非開示成分)と、製品ではなく原料に対する添加剤(キャリーオーバーと呼ばれる。防腐剤など)等、配合が極微量の成分は表示しなくてよいとされています〈*3〉。
医薬部外品に関しては、パラベン(防腐剤)など指定成分のみ表示が義務付けられ、全成分表示はしなくてよいこととされています。「美白」「UVカット」「アンチエイジング」などをうたい文句にした薬用化粧品(医薬部外品)には、どんな成分が配合されているのか私たち消費者には知らされていません。これは消費者への情報開示が積極的に求められるようになった社会の動向に反しています。
〈*3〉「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律第五十九条第八号及び第六十一条第四号の規定に基づき名称を記載しなければならないものとして厚生労働大臣の指定する医薬部外品及び化粧品の成分」(平成12年9月29日厚生省告示第332号)。
動物実験の廃止はメーカー次第
化粧品のために例外的に義務づけられている動物実験
- 「 化粧品基準」に示されるリストに新たな成分を追加したり、最大配合量の変更を申請する場合(化粧品基準の改正を求める場合)
- これまでの医薬部外品と異なる有効成分や新添加物を配合したり、有効成分の適用方法が明らかに異なる薬用化粧品等医薬部外品の製造販売を申請する場合
2001年の旧薬事法改正によって、上記のケースを除いて基本的に国から動物実験を求められるということはなくなりました。それにもかかわらず、いまだに動物実験をやめようとしないメーカーは、この例外を取り上げて、「法律で要求される」という言い訳を繰り返し、動物を苦しめ殺してでも新規性の高い成分の開発で利益を上げようと躍起になっています。
繰り返しになりますが、動物実験をしなくても化粧品をつくることは可能です。新規性の高い成分の開発を差し控えれば、動物実験を法律で要求されることはありません。どうしても新規性の高い成分を開発したい、というのであれば、動物実験に替わる代替法を確立させてからにするべきです。いまこそ、企業には倫理観をもって「動物実験をやめる」という決断を下すことが求められているのです。
化粧品基準改正要請時および医薬部外品の承認申請時に厚生労働省から求められる毒性試験の方法として挙げられている動物実験の例
※「医薬部外品の製造販売承認申請及び化粧品基準改正要請に添付する資料に関する質疑応答集(Q&A)について」(厚生労働省医薬食品局審査管理課 平成30年3月29日事務連絡)より抜粋
そのうち、代替法が認められている例
◾️遺伝毒性試験の代替法として
- 細菌復帰突然変異試験(OECD TG471)
- in vitro 哺乳類細胞染色体異常試験(OECD TG473)
- in vitro遺伝子突然変異試験(OECD TG476、490)
- in vitro 哺乳類細胞小核試験(OECD TG487)
◾️眼刺激性試験の代替法として
- 牛摘出角膜の混濁および透過性試験法(BCOP)(OECD TG437)
- ニワトリ摘出眼球を用いた眼刺激性試験法(ICE)(OECD TG438)
- ウサギ角膜由来株化細胞を用いた短時間暴露法(STE法)(OECD TG491)
- 再構築ヒト角膜様上皮モデル法(RhCE 法)(OECD TG492)
◾️皮膚感作性試験の代替法として
- in chemico皮膚感作性試験(OECD TG442C)
- 角化細胞株レポーターアッセイ(OECD TG442D)
- ヒト細胞株活性化試験(h-CLAT)(OECD TG442E)
◾️皮膚刺激性試験の代替法として
- 再構築ヒト表皮試験(OECD TG439)
◾️光毒性試験の代替法として
- 3T3-NRU 光毒性試験(OECD TG432)
◾️光安全性試験の代替法として
- ROSアッセイ(OECD TG495)
◾️吸収・分布・代謝・排泄試験の代替法として
- in vitro 皮膚吸収試験(OECD TG428)
2006年、厚生労働省発出の「医薬部外品の製造販売承認申請及び化粧品基準改正要請に添付する資料に関する質疑応答集(Q&A)」(厚生労働省医薬食品局審査管理課 平成18年7月19日事務連絡)の中で、「動物実験代替試験法による試験成績を申請資料として用いることは可能か」に対し、「OECD等により採用された代替試験法あるいは適切なバリデーションでそれらと同等と評価された方法に従った試験成績であれば差し支えない」としてOECD TG429,430,431,432の試験が代替法として取り上げられていた。
しかし、メーカーからの代替法を活用した承認申請の事例が増えなかったことから、4年後の2011年に「医薬部外品の承認申請資料作成等における動物実験代替法の利用とJaCVAMの活用促進について」(同 平成23年2月4日事務連絡)が出され、JaCVAMのホームページに掲載されている代替法の情報を活用するように周知が図られた。JAVAが国際キャンペーン〈*4〉により、10万筆を越える化粧品の動物実験廃止を求める署名を厚労大臣に提出した2014 年には、BCOP法(OECD TG437)についてのガイダンスが追加され、翌年にはICE法(OECD TG438)についてのガイダンス等も追加された。その後も代替法を活用するためのガイダンスが随時発出されている。
〈*4〉化粧品の動物実験を世界的に廃止させようと活動している動物保護団体Cruelty Free International(CFI)が、動物実験に反対する化粧品企業ザ・ボディショップと共に、2012年から全世界で展開してきた、化粧品の動物実験廃止を求める署名キャンペーン。JAVAはこのキャンペーンに日本のローカルパートナーとして協力した。
厚生労働省から発出された動物実験代替法に関する通知等
- 医薬部外品の承認申請資料作成等における動物実験代替法の利用とJaCVAMの活用促進について(平成23年2月4日)
- 皮膚感作性試験代替法及び光毒性試験代替法を化粧品・医薬部外品の安全性評価に活用するためのガイダンスについて(平成24年4月26日)
- 皮膚感作性試験代替法(LLNA:DA、LLNA:BrdU-ELISA)を化粧品・医薬部外品の安全性評価に活用するためのガイダンスについて(平成25年5月30日)
- 「 眼刺激性試験代替法としての牛摘出角膜の混濁および透過性試験法(BCOP)を化粧品・医薬部外品の安全性評価に資するためのガイダンス」について(平成26年2月4日)
- 眼刺激性試験を化粧品・医薬部外品の安全性評価に活用するための留意事項について(平成27年2月27日)
- 「 眼刺激性試験代替法としてのニワトリ摘出眼球を用いた眼刺激性試験法(ICE)を化粧品・医薬部外品の安全性評価に資するためのガイダンス」について(平成27年11月16日)
- In vitro皮膚透過試験(In vitro経皮吸収試験)を化粧品・医薬部外品の安全性評価に資するためのガイダンスについて(平成28年11月15日)
- 医薬部外品・化粧品の安全性評価のための複数の皮膚感作性試験代替法を組合せた評価体系に関するガイダンスについて(平成30年1月11日)
- 医薬部外品・化粧品の安全性評価における眼刺激性試験代替法としてのウサギ角膜由来株化細胞を用いた短時間暴露法(STE法)に関するガイダンスについて(平成30年12月18日)
- 医薬部外品・化粧品の安全性評価における眼刺激性試験代替法としての再構築ヒト角膜様上皮モデル法(RhCE 法)に関するガイダンスについて(令和1年6月24日)
- 医薬部外品・化粧品の単回投与毒性評価のための複数の安全性データを組み合わせた評価体系に関するガイダンスについて(令和3年4月22日)
- 医薬部外品・化粧品の安全性評価における皮膚刺激性評価体系に関するガイダンスについて(令和3年4月22日)
- 医薬部外品・化粧品の光安全性試験評価体系に関するガイダンスについて(令和4年10月27日)



